FORMACIÓN DE COMPUESTOS
¿Qué es un Compuesto Químico?

Un compuesto químico es una sustancia pura formada por la combinación de dos o más elementos químicos distintos que se unen en proporciones fijas mediante enlaces químicos. Esta unión produce propiedades diferentes a las de los elementos originales.
🔹 Los compuestos pueden estar formados por:
-
Moléculas (enlace covalente): agrupaciones de átomos no metálicos.
-
Redes cristalinas iónicas (enlace iónico): estructuras ordenadas entre metales y no metales.
EXTIENDE TU CONOCIMIENTO TEÓRICO
Ejemplos:
H₂O (agua): oxígeno e hidrógeno, ambos no metálicos.

NaCl (sal de mesa): sodio metálico y cloro no metálico.

Pasos para la Formación de Compuestos
Aquí se explican paso a paso cómo se forman los compuestos y cómo escribir sus fórmulas químicas correctamente:
1. Identificación de los elementos involucrados
-
Determina si son metales, no metales o poliatómicos.
-
Esto ayuda a saber el tipo de enlace químico que se formará:
-
Metal + No metal → Enlace iónico
-
No metal + No metal → Enlace covalente
-
2. Determinar la valencia o número de oxidación
-
La valencia indica la capacidad de combinación de un elemento.
-
Algunos elementos tienen valencia fija (ej: Na⁺ = +1), otros tienen Ejemplo:
-
Calcio (Ca) → +2
-
Oxígeno (O) → -2
3. Aplicar el cruce de valencias
-
Las valencias se cruzan para que la carga total del compuesto sea neutra.
-
Se colocan como subíndices (sin escribir el signo de la carga).
-
Ejemplo:
-
Ca⁺² y Cl⁻¹ → Fórmula: CaCl₂
4. Ajustar los subíndices si es necesario
-
Si se obtiene una fórmula con subíndices que puedan simplificarse (por MCD), se hace.
Ejemplo:
-
Al⁺³ y O⁻² → Al₂O₃ (ya simplificada)
5. Nombrar el compuesto según la nomenclatura correspondiente
-
Elige la nomenclatura más adecuada según el tipo de compuesto.
-
A veces hay más de una manera correcta de nombrar un mismo compuesto.
EJEMPLOS:
MIRA Y APRENDE SI TE QUEDARON DUDAS:

- NaCl - Cloruro de sodio
-
Tipo de enlace: Iónico
-
Elementos: Sodio (Na, metal), Cloro (Cl, no metal)
-
Valencias: Na⁺¹, Cl⁻¹
-
Fórmula: NaCl
-
Nombre:
-
Stock: Cloruro de sodio
-
Sistemática: Monocloruro de sodio (poco usual)
-
Tradicional: Cloruro sódico
-
- Fe₂O₃ - Óxido de hierro (III)
-
Tipo de enlace: Iónico
-
Elementos: Hierro (Fe, metal de valencia variable), Oxígeno (O)
-
Valencias: Fe⁺³, O⁻²
-
Fórmula: Fe₂O₃
-
Nombre:
-
Stock: Óxido de hierro (III)
-
Tradicional: Óxido férrico
-
Sistemática: Trióxido de dihierro
-
Tipos de Nomenclatura Química
Nomenclatura Sistemática (IUPAC)
Se basa en prefijos numéricos griegos que indican la cantidad de átomos.
Se usa especialmente en compuestos covalentes y óxidos no metálicos.
Prefijos comunes:
-
Mono- (1)
-
Di- (2)
-
Tri- (3)
-
Tetra- (4)
-
Penta- (5)
-
Hexa- (6)
Ejemplo: SO₂ → Dióxido de azufre
Nomenclatura de Stock
Indica la valencia del elemento metálico entre paréntesis con números romanos.
Es la nomenclatura oficial para compuestos con metales de valencia variable.
Ejemplo: CuCl₂ → Cloruro de cobre (II)
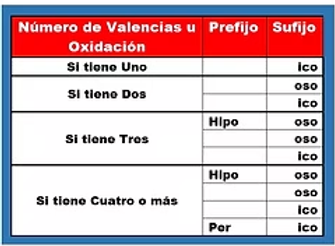
Nomenclatura Tradicional
Es un sistema para nombrar compuestos químicos utilizando prefijos y sufijos que indican la valencia o número de oxidación de los elementos en el compuesto.
Usa sufijos latinos: -oso (menor valencia), -ico (mayor valencia).
Cada metal tiene su nombre especial en latín.
Ejemplo: FeO → Óxido ferroso; Fe₂O₃ → Óxido férrico
REVISA EL SIGUIENTE VIDEO Y APRENDE TODAS LAS FORMAS POSIBLES DE NOMBRAR UN COMPUESTO
TE PRESENTO ALGUNOS EJEMPLOS PRINCIPALES DE NOMENCLATURA EN LA SIGUIENTE TABLA:



